気体の三法則
ここでは,熱力学において最も基本となる,気体の三法則( ボイルの法則 , シャルルの法則 , ボイル-シャルルの法則 )について 説明します.
ボイルの法則
1662年,ボイル(Robert Boyle)は, 温度を一定にした時 圧力を加えて空気の体積を測ると圧力と空気の体積とが互いに反比例するこ
とをつきとめました.その後,空気以外の体積でも,この関係が成り立つことが確かめられました.この法則は,気体の圧力を 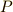 ,気体
の体積を
,気体
の体積を 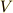 とすると,
とすると,

と表すことができます(ただし 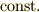 は,定数(Constant)を表しています).これを ボイルの法則 (Boyle's law)といいま
す.式(1)をグラフで表したものが下図です.
は,定数(Constant)を表しています).これを ボイルの法則 (Boyle's law)といいま
す.式(1)をグラフで表したものが下図です.
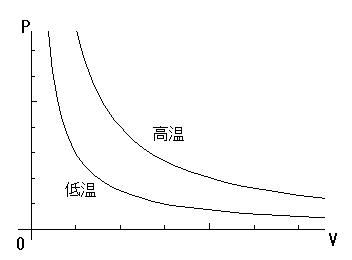
図で表すと,関数が温度によって一意に決定されていることがよくわかります.つまりボイルの法則は 温度を一定にした時 に 成り立つ,ということが重要なのです.忘れないでください.
シャルルの法則
1787年,シャルル(Jacques A.C. Charles)は, 圧力を一定にした時 気体の温度による膨張の割合(膨張率)が気体によらず一定で
あることを発見しました [*] .詳しい測定が行われた結果,0℃の時,及び 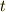 ℃の時の気体の体積をそれぞれ
℃の時の気体の体積をそれぞれ 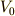 ,
, 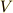 とすると
,膨張の割合は
とすると
,膨張の割合は

であることがわかりました.式(2)を書き改めると,
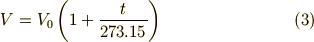
となります.これを シャルルの法則 (Charle's law)といいます.式(3)をグラフで表したものが下図です.
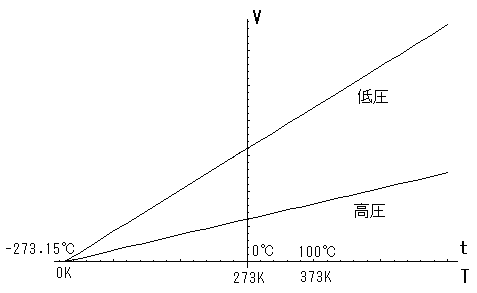
ここで,式(3)に 絶対温度 を導入してみましょう.絶対温度を 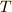 Kで表すと,
Kで表すと, 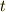 と
と 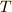 の間には
の間には

の関係が成り立つので,式(3)に式(4)を代入すると,
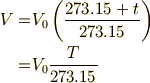
となります.これを少し変形すると,

になります. 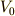 は気体の物質量と一定に保っている圧力によって定まる値ですから,定数と見なすことができます.つまり式(5)は
は気体の物質量と一定に保っている圧力によって定まる値ですから,定数と見なすことができます.つまり式(5)は

と書くことができるわけです.式(6)を見て,ピンときた方がいらっしゃることでしょう.そう,これは高校の化学の教科書で見かける シャルルの法則そのものです.式(3)と式(6)を見比べてみると,式(6)がいかにシンプルで美しいか,お分かりいただけると思います. 絶対温度を導入したことで,こんなにわかりやすくなるのですね!
シャルルの法則は 圧力を一定にした時 に成り立つ,ということが重要です.忘れないでください.
| [*] | シャルルのこの研究は,シャルル自身によって発表されることはありませんでした.1802年にゲイ・リュサック(Joseph L. Gay-Lussac)がこの法則を再発見しました. |
ボイル-シャルルの法則
ボイルの法則とシャルルの法則,両者を用いると,気体の圧力と体積と温度の間に成り立つ関係式

を導くことができます [†] .これをボイル-シャルルの法則といいます.ここで 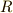 は定数です.ここではこの
は定数です.ここではこの 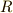 について詳しくお話
しませんが, 気体定数 と呼ばれている定数のことです.
について詳しくお話
しませんが, 気体定数 と呼ばれている定数のことです.
実はこの世に実在する気体は,式(7)を完全に満たすわけではありません.多くの実在気体は,高温・低圧の極限では式(7)を満たすことが わかっています.しかしそれ以外の条件では式(7)を満たしません.実在気体には,気体分子の大きさと相互作用が存在するからです. そこでこの法則がいかなる条件下でも成り立つ気体を仮想します.これを 理想気体 (ideal gas)あるいは 完全気体 (perfect gas)と いいます.理想気体は絶対温度と密接な関係があります.また,熱力学において非常に重要な役割を果たします.ここではとりあえず, 「そういう気体があるのだな」と頭の片隅に入れておいてください.
| [†] | 導出方法を詳しく知りたい方は,関連記事 ボイル-シャルルの法則の導出 をご覧ください. |