一重項と三重項とは
この記事は定性的な話で,短いです. 電子の基底状態に二電子を入れることを考える時に, 一重項(シングレット)と三重項(トリプレット)という概念が重要になってきます.
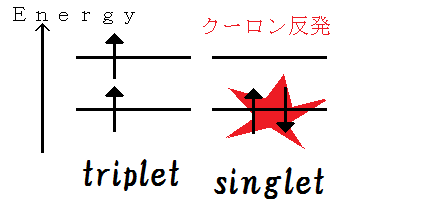
電子の持つスピンには上向きと下向きの二状態があります. エネルギーの低い軌道に二電子を詰める時,平行で同じ向きなのが三重項,平行で逆向き(反平行といいます)なのが一重項と言います.
三重項
パウリの排他律という原理がありまして,一つの軌道には同じ量子数(ここではスピン量子数)を持つ電子(つまり,三重項)は 二つ以上は入れません.よって,電子は低い方から順に別の二つの軌道に入ることになります.軌道に縮退がなければ,一番下に一個,二番目に一個入ります.この場合,一番下に二つ入る方がエネルギーが低かったのに…….ってなことになります.
一重項
では,スピンが反平行だったら,どうでしょう? この場合,確かに異なるスピン量子数を持つので,同じ最低軌道に入れます. しかし,パウリの排他律は似たような,しかし別の現象についても言及します. つまり,「同じ量子数を持つ二電子は同一点に接近できない.」ということが起こるのです. この中の一電子に注目すると,もう一つの電子分布は注目する電子の周辺にはなく 穴があいています.これを「フェルミホール」がある.と表現します. すると,スピンが平行な三重項の二電子は,近くに来ることはできませんから, クーロン反発が弱くなる分,エネルギーの得をします. 逆に反平行な二電子は,近くに接近できる分,大きなクーロン反発をもってエネルギーが大きくなってしまいます.
基底状態の候補
つまり,軌道のエネルギー損とクーロン反発のエネルギー損が競合するのです. よって,状況によってどちらが基底状態になるのか,一概には言えないのです. しかし,ここで重要なのは,二電子の基底状態は「一重項」か「三重項」のどちらかになる.ということです. だから,一重項や三重項は重要な概念なのです.
一と三の名前の由来
言い忘れましたが,なぜ一重項,三重項というのか,について触れておきます.
「スピンの合成」という概念があります.
個々のスピン量子数を 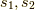 .全体のスピンを
.全体のスピンを 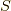 ,全体のスピンのz成分を
,全体のスピンのz成分を 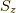 とすると,
状態は,
とすると,
状態は, 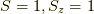 ,
, 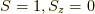 ,
, 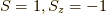 ,
, 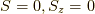 の四状態が生成されます.
前三つはスピンが平行な状態を表しているので,三重項.
最後の一つはスピンが反平行な状態を表しているため,一重項と呼ぶのです.
の四状態が生成されます.
前三つはスピンが平行な状態を表しているので,三重項.
最後の一つはスピンが反平行な状態を表しているため,一重項と呼ぶのです.
それでは今日はこの辺で.お疲れ様でした.