標準反応エンタルピーと標準エントロピー及び標準反応ギブズエネルギー
私が大学の教養課程において,これが分からず化学系に行くのを断念しました [*] . 同じ轍を踏む人がいないようにこの記事を書きます. これは,熱化学表の見方を勉強しようというものです.
| [*] | そう,ある意味,だから僕は物理系なのよ. |
エンタルピー
エンタルピー 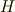 とは,次のような量です.
とは,次のような量です.

ただし 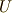 は系の内部エネルギー,
は系の内部エネルギー, 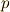 は圧力,
は圧力, 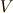 は体積です.
ここで熱力学第一法則を微分形で書くと,
は体積です.
ここで熱力学第一法則を微分形で書くと,

よって,エンタルピーの微分形は,
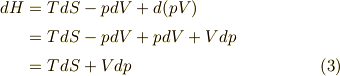
エンタルピーは定圧変化において威力を発揮します.
化学反応が起きて,気体が発生したとしましょう.
内部エネルギー変化 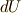 は
は 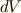 を含むので気体の体積変化を考慮しなければなりません.
を含むので気体の体積変化を考慮しなければなりません.
しかし,エンタルピー変化は定圧条件 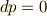 の元では,
エントロピーの微分形の定義,
の元では,
エントロピーの微分形の定義,

つまり [†] ,
| [†] | 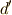 は不完全微分を表すのでした.反応の始点と終点が共通でも,この不完全微分の量は反応経路により,
変わってきます.状態量にはなりえないのです. は不完全微分を表すのでした.反応の始点と終点が共通でも,この不完全微分の量は反応経路により,
変わってきます.状態量にはなりえないのです. |

より,

となり,状態量 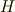 の変化量
の変化量 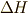 で出入りする熱量
で出入りする熱量 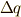 が表現できるのです.
が表現できるのです.
特に反応の始点と終点が共に標準状態(その物質のある温度における圧力 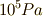 の下での純粋な形で存在する状態です.)
の時に,出入りする熱量を標準反応エンタルピー
の下での純粋な形で存在する状態です.)
の時に,出入りする熱量を標準反応エンタルピー 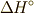 と言います.これは,
高校までの化学において,反応熱と言う概念がありましたが,それの符号を変えたものが標準反応エンタルピー
だと考えて良いと思います.「符号を変える」とは,どういうことかというと,エンタルピーは,メタンなどのようにエネルギーをたくさんもっている物質では高く,二酸化炭素のようにエネルギーをあまりもっていない物質では,低いからです.
メタンが酸素と反応(燃焼)して,どれだけエネルギーを減らしたかが反応エンタルピー(
と言います.これは,
高校までの化学において,反応熱と言う概念がありましたが,それの符号を変えたものが標準反応エンタルピー
だと考えて良いと思います.「符号を変える」とは,どういうことかというと,エンタルピーは,メタンなどのようにエネルギーをたくさんもっている物質では高く,二酸化炭素のようにエネルギーをあまりもっていない物質では,低いからです.
メタンが酸素と反応(燃焼)して,どれだけエネルギーを減らしたかが反応エンタルピー( 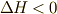 )なのです.
この時,反応熱
)なのです.
この時,反応熱 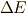 は,どれだけ熱を放出したかでしたので,
は,どれだけ熱を放出したかでしたので, 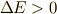 ですね.
この様に,反応熱と反応エンタルピーの符号が反対なのは,よろしいでしょうか?
ちなみにエンタルピーの計算では,反応にかかわる一つの物質
ですね.
この様に,反応熱と反応エンタルピーの符号が反対なのは,よろしいでしょうか?
ちなみにエンタルピーの計算では,反応にかかわる一つの物質 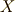 に注目し,それが一モル反応または生成する時のエンタルピーを
用い,標準モルエンタルピー
に注目し,それが一モル反応または生成する時のエンタルピーを
用い,標準モルエンタルピー 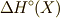 と呼びます.そして,
と呼びます.そして, 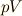 は気体などの生成に際し,圧力をもって外に仕事をする,その仕事まで考えていると言っていいでしょう.
は気体などの生成に際し,圧力をもって外に仕事をする,その仕事まで考えていると言っていいでしょう.
エントロピーとギブズの自由エネルギー
孤立系において,エントロピーは上昇する方向に反応は進行するというのが,熱力学第二法則の言わんとすることでした.
ここで,定圧等温過程を考えます.そして,系 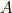 が熱浴
が熱浴 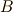 の中に入っている時を考えます.
の中に入っている時を考えます.
エネルギーの保存則から,全体のエンタルピー変化 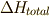 はありませんから,
はありませんから,
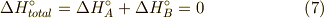
となります. 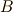 のエントロピー変化は,等温過程なので,
のエントロピー変化は,等温過程なので, 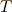 一定より,簡単に計算できて,
一定より,簡単に計算できて,
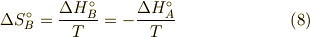
注意して欲しいのは,
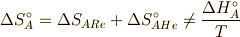
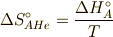
であります.ここで, 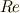 はReactionで反応の,
はReactionで反応の, 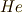 はHeatで,仕事と熱のやり取りのエントロピー変化を
表します.化学反応や混合,相変化などにより,熱のやり取り以上にエントロピーが生成する [‡] のです.
はHeatで,仕事と熱のやり取りのエントロピー変化を
表します.化学反応や混合,相変化などにより,熱のやり取り以上にエントロピーが生成する [‡] のです.
| [‡] | 後の議論を見てもらえれば分かるかと思いますが,エンタルピーの減少する反応や相変化ならば,エントロピーが減少するこ ともあります.例えば,気体同士の反応で,容積が減る反応 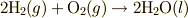 等の反応が挙げられます.熱の移動を含めたエントロピーがトータルで増加する(ギブズエネルギーが減少する)反応が自発的 に起こる反応です. 等の反応が挙げられます.熱の移動を含めたエントロピーがトータルで増加する(ギブズエネルギーが減少する)反応が自発的 に起こる反応です. |
ここで,第二法則よりエントロピーが増える方向にしか反応が進まないので, 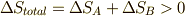 より,
より,
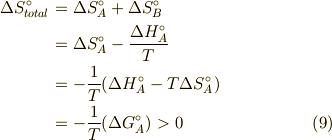
最後の行の 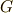 とは,ギブズの自由エネルギー(標準反応ギブズエネルギー)であり,
とは,ギブズの自由エネルギー(標準反応ギブズエネルギー)であり,
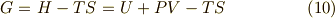
で定義されます.
よって,第二法則より化学反応は,ギブスの自由エネルギーが減少する方向にしか,進まないことが分かりました.
少しこの式の持つ意味を考察してみましょう.低温では, 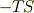 が小さいので反応エンタルピーが反応方向の決定に
大きな影響を及ぼします.逆に高温だと,
が小さいので反応エンタルピーが反応方向の決定に
大きな影響を及ぼします.逆に高温だと, 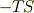 は負の大きな値をもつので,反応のエントロピー変化が,
大きな影響を及ぼすことになります.
は負の大きな値をもつので,反応のエントロピー変化が,
大きな影響を及ぼすことになります.
ちなみに,物質のエントロピーの計算は面倒ですが,熱力学第三法則(絶対零度において物質のエントロピーはゼロに等しい.) を利用して計算するようです.
以上で,熱化学表を読むことができるようになるための, 基礎論を終了します.今日は,ここまで.お疲れ様でした.