熱力学第1法則(導入編)
ここでは熱力学第1法則とはどのようなことを表したものなのか,複雑な数式などは一切使わずに簡単な図と文章と式で説明していこうと思 います.
文章で表す
熱力学第1法則を,まず文章で書き表してみます.目を通してみてください.
熱力学第1法則 : 一つの物体系を,定められたはじめの状態から,定められた終わりの状態へいろいろの方法で移す時,物体系に与えられた力学的仕事と熱量の和は常に一定である.
う〜ん…わかったようなわからないような….何を言っているのか,具体的な例を挙げて,もう少しわかりやすく説明していきましょう.
式で表す
下図をご覧ください.
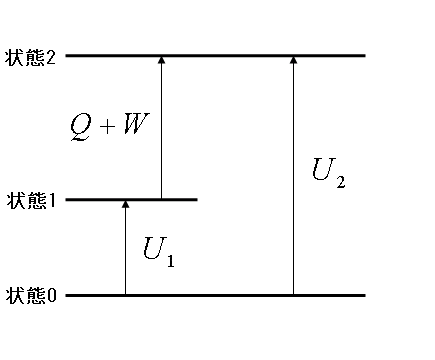
今,図に示したように,一つの物体系を状態0から状態2へ移動させることを考えます.この時,状態1を経て状態2へ移動させる場合と,直
接状態2へ移動させる場合,両方の場合を考えます.状態0から状態1へ移す時に物体系に与えた仕事と熱量の和を 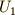 ,状態0から状
態2へ直接移す時に物体系に与えた仕事と熱量の和を
,状態0から状
態2へ直接移す時に物体系に与えた仕事と熱量の和を 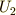 とします.さらに,状態1から状態2に移す時に与えた仕事を
とします.さらに,状態1から状態2に移す時に与えた仕事を 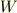 ,熱量を
,熱量を
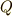 とします.
とします.
物体系を状態0から状態2へ移動させる という移動開始時の状態と移動終了後の状態だけに着目するならば,状態1を経ようが経まいが, 物体系が与えられた熱量と仕事の総和は同じになることは明らかです.ゆえに次式が成り立ちます.

式(1)を変形すると

となります.実はこれが式で表した 熱力学第1法則 です.今ここでは移動開始時の物体系の状態を状態0にしました.この状態0を基準
状態にしたわけです.式(2)の 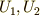 は基準状態と各状態によって定まる量で, 内部エネルギー とよばれるものです.内部エ
ネルギーとは,物体が内部に持つエネルギーのことです [*] .
は基準状態と各状態によって定まる量で, 内部エネルギー とよばれるものです.内部エ
ネルギーとは,物体が内部に持つエネルギーのことです [*] .
式(2)は,内部エネルギーの差  が基準状態によらず,各状態だけで決まることを表しています.つまり,内部状態の差を求
めやすくするために基準状態を任意に定めて良いのです [†] .また,式(2)は,物体系に仕事と熱量,どちらか一方だけ加えたとしても
物体系の内部エネルギーに変化をもたらすことができる,ということを表しています.もう少し違う言い方をすると,状態1と状態2を定め,
内部エネルギーの差を求めることができたとしても,加えた仕事と熱量の具体的な値は求めることができない,ことを表しているのです.
が基準状態によらず,各状態だけで決まることを表しています.つまり,内部状態の差を求
めやすくするために基準状態を任意に定めて良いのです [†] .また,式(2)は,物体系に仕事と熱量,どちらか一方だけ加えたとしても
物体系の内部エネルギーに変化をもたらすことができる,ということを表しています.もう少し違う言い方をすると,状態1と状態2を定め,
内部エネルギーの差を求めることができたとしても,加えた仕事と熱量の具体的な値は求めることができない,ことを表しているのです.
| [*] | これだけの説明では,「結局,内部エネルギーって何?」と思われる方も多いと思います.熱力学とは「巨視的(マクロ)な立場で熱現象を一般に扱う学問」であるため,熱量を含めたエネルギー保存の法則を考えた時に,内部エネルギーを導入することがどうしても必要だったのです.統計力学的な観点から見ると,なぜ内部エネルギーというものが存在するのかがわかります.気体を構成している原子・分子というミクロなものの存在を考慮するからです.一つ一つの気体分子がもつエネルギーの平均を,気体を構成している分子の数だけ合わせたものが,実は内部エネルギーの正体です. |
| [†] | これは,力学の位置エネルギーを求める際に用いた方法とよく似ています.力学的エネルギーを求める際,常に地球の地面を基準の位置にしたわけではありませんでしたね.考えやすいように,基準の位置をビルの屋上にしたり,台の上にしたり,色々変更することが可能でした.内部エネルギーを求めるときに,それと同様のことをしてかまわない,ということなのです. |
両方を比較する
さて,熱力学第1法則を文章・式の両方で表してきました.振り返ってみると,文章で表した方の意味が最初に比べて理解しやすくなって いると思います.熱力学第1法則をどちらの説明でも理解できるようにしておくことが大切です.